
 |
||||||
|
|
||||||
|
Experimentos de química.
|
||||||
|
|
||
| Erupción en un vaso. | ||
| Colores por agitación. | La cáscara de naranja. Nuevo... |
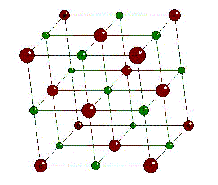 |
¿Alguna vez observaron de cerca, por ejemplo con ayuda de una lupa, los granitos de sal común? Verán que muchos de esos granitos son cubos mas o menos perfectos. Un aspecto similar (pero no igual) tienen los granitos de azúcar. Esa forma externa tan regular revela que los átomos o las moléculas que forman esos cristales están sumamente ordenados. En la sal común, por ejemplo, existen átomos cargados eléctricamente (iones) ordenados como muestra la figura, donde los iones rojos son cloruros (Cl-) y los verdes son sodios (Na+). Esos iones se muestran separados entre sí para que pueda verse claramente el ordenamiento, pero en realidad están en contacto. Los átomos e iones son increiblemente pequeños. Imaginemos que los iones que forman nuestro granito de sal crecen hasta tener 1 cm de diámetro (el tamaño de un garbanzo) ¿de qué tamaño sería el grano de sal? ¡¡Sería un cubo de unos 17 kilómetros de lado!!.... |
|
Si disolvemos un poco de sal en agua y luego dejamos evaporar la solución, la sal vuelve a cristalizar, vuelve al estado sólido, aunque probablemente los cristales que se formen sean muy pequeños e imperfectos. Existen otras sales que pueden conseguirse fácilmente (en una farmacia o una ferretería), con las cuales podemos intentar obtener cristales grandes y bien formados. Dos de esas sales son el sulfato de cobre (una sustancia azul que se utiliza para desinfectar plantas) y el alumbre común (sulfato doble de aluminio y potasio). Veamos como proceder: Sulfato de cobre: Moler la sustancia hasta obtener un polvo fino (para acelerar la disolución). En un frasco de vidrio (como los utilizados para mermeladas, café instantáneo, etc.) verter unas 8 cucharadas rasas de sulfato de cobre molido (aprox. 70 u 80 g) y medio vaso de agua (aprox. 100 ml). Colocar el frasco dentro de una olla o lata con agua y calentar a ebullición (baño de María), manteniendo unos 15 a 20 minutos. La sal se disolverá hasta que la solución esté saturada, quedando un resto de sal sin disolver. Cuidando de no quemarse los dedos, filtrar la solución en caliente a través de un trozo de algodón, tela fina o papel de filtro para café, a otro frasco limpio. Dejar reposar la solución límpida en el frasco tapado con un papel en un rincón tranquilo. Al poco tiempo (horas o días, según el grado de saturación de la solución) comenzarán a formarse pequeños cristales azules, que irán creciendo con el correr de los días, alcanzado algunos cm de longitud. Pueden intentarse también las dos variantes siguientes:
Alumbre común: Proceder como antes, pero disolviendo 3 o 4 cucharadas rasas (unos 30 g) de alumbre bien molido en medio vaso de agua. El alumbre forma fácilmente hermosos cristales incoloros con forma de octaedros (como si fueran dos pirámides de Egipto unidas por las bases). |
|
Un polímero está formado por una larga cadena de miles de moléculas pequeñas que se repiten, como las cuentas de un collar. Según el tipo de molécula, la longitud de las cadenas, la unión de esas cadenas entre sí para formar estructuras tridimensionales, etc., tendremos un polímero líquido o sólido, con distintas propiedades. Por supuesto que la gran inventora de polímeros es Mamá Naturaleza (por ejemplo, los tejidos con los que estamos "armados" los seres vivientes, animales y vegetales, son polímeros), pero existen docenas y docenas de polímeros sintetizados por los químicos, algunos de los cuales tienen nombres comerciales que todos conocemos: Nylon, Teflon, Dacron, poliamidas, etc., etc... Muchos pegamentos comunes son polímeros. Por ejemplo, los adhesivos vinílicos que se compran en la ferretería o en la librería para pegar madera, papel, etc., tienen como componente principal al acetato de polivinilo, donde cada "cuenta de collar" es un grupito de átomos como el que se muestra a la izquierda: |
 |
 |
|
Podemos cambiar drásticamente las propiedades de este polímero líquido haciendo que esas cadenas se unan entre sí "de costado", como muestra el dibujo de la derecha, lo que se consigue mezclandolo con una solución de bórax. El bórax es el nombre común del borato de sodio, que es una sal del elemento boro. La receta es así:
|
 Líquidos
de raro comportamiento.
Líquidos
de raro comportamiento.
|
Existen algunos líquidos que presentan comportamientos realmente extraños, debidos a la composición química y estructura de las moléculas que lo forman o al tipo de interacción de esas moléculas o partículas con el solvente, cuando se trata de una solución o suspensión. Veremos uno de esos casos, que puede ubicarse dentro del último grupo mencionado: Pongamos en un vaso algunas cucharadas de almidón de maíz (Maicena, p.ej.) y agreguemos agua como para formar una papilla bastante líquida, revolviendo con una cucharita. Ya desde el principio notaremos que no es lo mismo que preparar otras mezclas comunes en la cocina: cuesta bastante mover la cucharita. En realidad, es posible revolver lentamente, pero en cuanto aumentamos la velocidad de agitación, la resistencia al movimiento crece notablemente. Con un movimiento lento no sera dificultoso hundir la cucharita hasta el fondo, pero si intentamos un movimiento brusco, se encontrará nuevamente una gran resistencia. Tomemos el vaso con una mano y hagamoslo mover rápidamente en círculos. Si el líquido fuese agua o leche, ya se habría volcado... Pero eso no ocurre con el líquido blanco que preparamos. Otra prueba que demuestra el comportamiento extraño de este líquido consiste en volcarlo a otro recipiente en forma de chorro fino. Veremos que no tenemos un chorro uniforme y perfectamente vertical como ocurriría con el agua, sino que oscila y se mueve como si estuviera bailando... Este comportamiento poco común ubica al líquido que preparamos entre los llamados fluidos no Newtonianos, y a este en particular, entre los fluidos dilatantes. Un sistema con propiedades comparables son las llamadas "arenas movedizas": se trata de una mezcla de arena y agua en la que pueden quedar atrapados animales o personas incautas. También en este caso un movimiento brusco hace que la mezcla se vuelva más rígida, dificultando o imposibilitando los movimientos. Otro fluido no Newtoniano que encontramos en la cocina es el ketchup: generalmente ocurre que al volcar el recipiente de ketchup el contenido no salga, no se vierta. Es necesario agitar fuertemente para que el contenido se vierta con facilidad. Ocurre que la viscosidad del fluido disminuye al agitarlo, promoviendo el movimiento de las moléculas entre sí. Luego de algunos minutos la viscosidad vuelve a aumentar. Ese comportamiento es típico de los llamados fluidos tixotrópicos, y tiene considerable importancia en algunos productos industriales, como las pinturas. En efecto, al pintar con pincel, por ejemplo, se promueve el movimiento de las moléculas entre sí, la viscosidad disminuye y la pintura se extiende fácilmente. Pero la viscosidad debe aumentar rápidamente después de pintar, para evitar las "chorreaduras"... |
| Los metales tienen cierta tendencia a disolverse en el agua,
unos más, otros menos. Si sumergimos una chapa de cinc en agua, algunos
átomos de cinc perderán dos electrones (o sea, dos cargas
negativas) y se convertirán en iones (cinc)++, con dos cargas positivas.
Sin embargo, esos iones se quedan "pegados" al metal, porque no
quieren alejarse de los electrones (¡cargas de distinto signo se atraen!).
Pero si hay algo que se lleve los electrones, entonces si que esos iones
(cinc)++ pasarán a la solución. Probemos el siguiente experimento:
Preparamos una solución de sulfato de cobre, como la mencionada
en el experimento de los cristales (se puede preparar en frío y
no hace falta que sea saturada). Ahora tomamos un trozo de alambre galvanizado
bien limpio y lo sumergimos en la solución. Veremos que el alambre
queda cubierto por una capa de cobre de color rojizo. ¿Qué
pasó? (cobre)++ + 2(electrones)- => cobre metálico Y entonces si, los iones (cinc)++ que se habian formado pueden pasar a la solución. En resumen: un poco de cinc se disuelve y un poco de cobre se deposita. Pero si logramos que esos electrones no pasen directamente del alambre
a la solución sino que circulen por un cable externo, habremos
armado una pila eléctrica. |
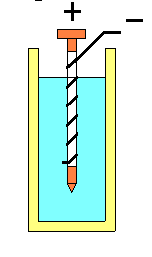 |
Tomamos un trozo de unos 5 o 6 cm de alambre de cobre grueso (o un clavo de cobre de los que se usan para fijar las tejas en los techos), lo limpiamos bien con una lija fina, lo envolvemos con 2 o 3 vueltas de papel común y le enrollamos varias vueltas de alambre galvanizado, cuidado que los metales no se toquen. Luego sumergimos todo en un frasquito conteniendo vinagre, como muestra la figura, y...lista nuestra pila. Ahora la cuestión es ver si funciona. Hay varias maneras de comprobarlo: - Si tenemos a mano un multímetro (aparato que se usa para medir voltaje o resistencia eléctrica, etc.), podemos medir el voltaje que genera nuestra pila, que será de aproximadamente 1 V. - Uniendo en serie dos pilas iguales con un cablecito (polo negativo de una pila al polo positivo de la otra) tendremos un voltaje de 2 V. Eso es suficiente para encender un LED (Light Emitting Diode o Diodo Emisor de Luz) de color rojo, que se consigue en los negocios de electrónica y es muy barato. Los LED encienden si la polaridad es la adecuada; si no enciende, invertir las conexiones a la pila. |
|
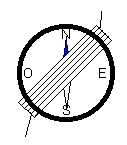
- Podemos fabricar un "detector de electricidad" enrollando varias vueltas (20 o 30) de alambre de cobre fino (esmaltado o aislado de alguna manera) sobre una brújula, como se ve en la figura. Si conectamos las terminales de la bobina así construida a una pila, veremos que la aguja de la brújula se mueve, indicando que circula electricidad. Ese movimiento será muy leve con nuestra pila, que genera poca intensidad de corriente. Si probamos con una pila comercial de 1,5 V, veremos un rápido giro de la aguja hasta una posición perpendicular a la bobina. |
 |
Otra manera de armar esta pila: cortar círculos o cuadrados de chapa galvanizada, chapa de cobre y cartón bien poroso. Embeber las piezas de cartón con vinagre. Hacer un "sandwich" superponiendo: cobre / cartón / cinc / cobre / cartón / cinc...con tantas capas como nos parezca, y habremos armado una verdadera "pila"...(de allí viene el nombre, después que don Volta armó las primeras el siglo pasado).
 Otro experimento con dos metales.
Otro experimento con dos metales.
| En el experimento "De metales y pilas"
vimos como el cinc se disuelve en una solución de sulfato de cobre
y se forma cobre metálico. Vamos a repetir el experimento, que va a ser bastante más impresionante si lo hacemos con aluminio en lugar de cinc. Disolvemos una cucharadita abundante de sulfato de cobre (bien molido) y una cucharadita de sal común (que es cloruro de sodio) en medio vaso de agua. En la solución de color celeste sumergimos un trozo de papel de aluminio. Veremos que en pocos minutos sobre el aluminio aparecen zonas obscuras de cobre metálico y también se observa desprendimiento de burbujas de gas, que es hidrógeno (formado en una reacción secundaria). Al cabo de un rato el aluminio se habrá disuelto completamente, dejando un depósito de cobre metálico de color rojizo. Aquí otra vez es el metal que se disuelve el que proporciona electrones para que se produzca la reacción: (cobre)++ + 2(electrones)- => cobre metálico ¿Se podrá armar una pila con esos dos metales? La teoría dice que sí, pero es cuestión de probar... |
||||
 |
 |
 |
||
|
El agua pura no es ni ácida ni alcalina. Es neutra. Pero cuando se disuelven cosas en agua, se obtienen soluciones que probablemente ya no sean neutras. Serán ácidas, como el vinagre, el jugo de limón, etc., o alcalinas (también denominadas básicas), como el agua de cal, algunos jabones, algunos líquidos limpiadores de uso doméstico, etc. Para determinar si una solución es ácida o alcalina, los químicos usan sustancias llamadas indicadores, que cambian de color según como sea la solución que se estudia. Mamá Naturaleza nos ofrece algunos de esos indicadores en la forma de los colorantes de las flores y otros vegetales (esos colorantes se llaman antocianinas). |
 |
Veamos como se prepara fácilmente una solución de indicador. Necesitaremos algunas campanillas azules, esas flores de las enredaderas que crecen en muchos terrenos baldíos y que se muestra en la figura. También pueden servir algunas hojas de repollo colorado. Tomamos esas flores u hojas, las convertimos en tiras finas con un cuchillo, las colocamos en un vaso, las cubrimos con un poco de alcohol fino y dejamos reposar durante 15 o 20 minutos. Obtendremos así un líquido hermosamente coloreado. |
| Otra posibilidad es cortar el vegetal en tiras
finas, colocarlo en un recipiente de pyrex o de acero inoxidable y cubrirlo
con agua hirviente. Dejar enfriar el líquido hasta temperatura ambiente. Luego de decantar o filtrar el líquido obtenido a través de un trozo de tela o algodón, o de un papel de filtro para café, tendremos listo nuestro indicador. Pongamos un poco del indicador en dos vasos y agreguemos a uno, unas gotas de vinagre (ácido): el líquido tomará color rojo; al otro, unas gotas de limpiador desengrasante para cocina o de amoníaco o media cucharadita de bicarbonato de sodio (álcali): el indicador tomará color verde. Tendremos entonces: Solución de indicador + ácido: color rojo Solución de indicador (neutro): color azul o violeta Solución de indicador + álcali: color verde Pero esas reacciones pueden invertirse. Si a la solución ácida
de color rojo le agregamos un poco de solución alcalina (como limpiador
desengrasante) el color virará a verde, pasando por azul/violeta.
O sea que la solución ácida es neutralizada por el álcali,
y finalmente se vuelve alcalina. Y teniendo un indicador que funciona bien, intentemos determinar si los distintos líquidos que encontramos en nuestra casa o nuestro cuerpo son ácidos o alcalinos... |
Otro indicador: Podemos preparar fácilmente un indicador comprando un chicle laxante (conteniendo fenolftaleina) en la farmacia y agitándolo en un vaso con un poco de agua. Luego filtrar para obtener una solución límpida. La solución así obtenida será incolora en medio ácido o neutro y tomará color rosado violáceo en medio alcalino.
|
Y para qué sirve la tinta invisible?...Respuesta: para escribir mensajes secretos que pueden leer solo aquellos que sepan como revelarlos. Es un método que usaban algunos prisioneros de guerra para mantenerse comunicados entre sí. Veamos un par de métodos para escribir esos mensajes: 1.- Escribir el mensaje en una hoja de papel blanco con leche o jugo de limón, usando una pluma o un palito de madera con punta como lapicera (conviene usar trazos gruesos), y dejar secar. El mensaje puede revelarse calentando la hoja de papel con una plancha bien caliente o en el horno de la cocina (con el permiso de su dueña...). 2.- Escribir de la misma forma con una solución de almidón, preparada mezclando una cucharadita de almidón de maíz (maicena) o de trigo con 1/4 taza de agua, calentando hasta ebullición y dejando enfriar. El mensaje se revela mojando la hoja de papel con una solución diluída de yodo, que se prepara agregando varias gotas de tintura de yodo (que se compra en la farmacia) a 1/4 taza de agua. El escrito aparece en color azul sobre un fondo celeste. Y ya que estamos, probemos de agregar una gota de tintura de yodo a varios mililitros de solución de almidón, agitando el recipiente después. El color azul oscuro, casi negro, que aparece explica el "funcionamiento" de la tinta invisible que describimos y es una manera que usan los químicos para detectar la presencia de pequeñísimas cantidades de yodo. |
| En cualquier hoja de una planta hay un laboratorio
maravilloso, casi mágico. La planta absorbe anhidrido carbónico
del aire (ese gas que produce el efecto invernadero y el recalentamiento
de nuestro planeta), toma agua y minerales a través de las raíces
y con ayuda de la luz del Sol, fabrica almidón, azúcares,
grasas, proteinas, etc. y libera oxígeno. ¡Ese oxígeno
que todos necesitamos para respirar! Pero...¿cuanto oxígeno hay en el aire? Respuesta: 21%, o sea, algo así como una quinta parte (1/5). El resto es casi todo nitrógeno. Podemos comprobar fácilmente que esa es la cantidad de oxígeno en el aire mediante estos dos sencillos experimentos: 1.- En este primer experimento se trabaja con fuego, que siempre es peligroso. Por esa razón los niños necesitarán del permiso y vigilancia de una persona mayor. En el centro de una olla grande o una palangana y usando masilla o plastilina fijamos una velita de torta de cumpleaños (o un cabo de vela común). Luego agregamos agua en el recipiente hasta una altura de 1 cm., aproximadamente. Encendemos la vela y luego la cubrimos con un frasco de vidrio (de mermelada o café), hasta que la boca del frasco quede sumergida en el agua. Veremos que después de algunos segundos la llama se extingue y el agua sube en el frasco. ¿Qué pasó? La llama resulta de la combinación de la cera de la vela, fundida y a alta temperatura, con el oxígeno del aire. Cuando el oxígeno existente en el interior del frasco se consume, la llama se extingue y el agua entra a ocupar el espacio que antes ocupaba ese oxígeno. Si el frasco es cilíndrico, podemos comprobar que el agua subió aproximadamente 1/5 de la altura del frasco. En realidad, parte del agua sube porque se enfría y contrae el aire en el interior del frasco, previamente calentado por la llama de la vela. Ese problema no existe en el siguiente experimento: |
|
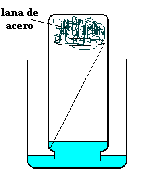
2.- Repetiremos el experimento pero ahora absorbiendo el oxígeno a temperatura ambiente. Para eso, colocamos un trozo de lana de acero (de la que se usa para frotar las ollas en la cocina) en el fondo del frasco del experimento anterior, sujetándolo con una maderita o un trozo de alambre de manera que no se caiga al invertir el frasco. Luego de humedecer bien con agua la lana de acero, apoyamos el frasco invertido dentro de un recipiente que contenga un poco de agua, como se ve en la figura (si es agua coloreada con unas gotas de tinta, etc., se verá mejor) y dejamos todo en un lugar tranquilo. Luego de algunos días veremos que el agua asciende en el frasco. Esta vez el oxígeno contenido en el aire encerrado en el frasco se combina lentamente con el hierro, oxidándolo, y nuevamente vemos que el agua asciende en el frasco ocupando el lugar del oxígeno consumido. También en este experimento se comprueba que el agua sube para ocupar aproximadamente 1/5 de la altura del frasco. |
 |
| Todas las sustancias comunes se encuentran en alguno de esos
tres estados: Sólidos como un trozo de madera, un cubito de hielo,
una piedra... Líquidos como el agua, el alcohol, la nafta... Gases
como el aire (que es principalmente una mezcla de dos gases: oxígeno
y nitrógeno), el gas que usamos para cocinar, el anhidrido carbónico
(que le da las burbujas a las bebidas gaseosas)... Y las sustancias puras
pueden pasar de un estado al otro, según la temperatura. Si ponemos
unos cubos de hielo (agua sólida) en una olla y los calentamos, se
funden (pasan a agua líquida) y finalmente el agua hierve y se evapora
(pasa a vapor de agua, un gas). Si ponemos una cuchara fría sobre
el vapor de agua, esta condensará nuevamente a agua líquida. Pero algunas sustancias prefieren pasar directamente del sólido al gas, sin pasar por el líquido (eso se llama sublimación). Para ver ese fenómeno, hagamos el siguiente experimento: En un frasco de vidrio (de café, mermelada, etc.) colocamos una
bolita de naftalina (la que se usa para combatir las polillas), tapamos
el frasco y lo calentamos en una ollita conteniendo un poco de agua (a
baño maría). Cuando el agua esté bastante caliente
(unos 80ºC), pongamos un paño humedecido con agua enfriando
la parte superior del frasco, manteniendo todo durante 5 o 10 minutos.
Veremos que en la parte fría del frasco se habrán formado
cristalitos brillantes de naftalina, como pequeñas hojitas. |
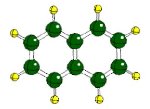 |
Nuevamente, como en el primer experimento de este capítulo, observamos la formación de cristales. Pero ahora no estarán formados por átomos con cargas positivas y negativas (iones) de forma esférica, como pequeñas bolitas. Los cristales de naftalina (naftaleno para los químicos) están formados por moléculas como la que se ve en la figura, que son en este caso una agrupación de átomos de carbono (color verde en la figura) formando un doble anillo, con átomos de hidrógeno (color amarillo) unidos a algunos carbonos. |
|
Cuando calentamos la bolita de naftalina, muchas de estas moléculas salen volando y forman un gas, que se mezcla con el aire del frasco. Pero en cuanto tienen la oportunidad y encuentran una pared más fría en el frasco, esas moléculas se unen nuevamente entre sí para formar la naftalina sólida, sin pasar por el líquido. Y los gases comunes, pueden convertirse en líquidos? Sí que pueden. Si el aire común se comprime y enfría lo suficiente (¡a unos 200 grados bajo cero!), pasa al estado líquido. En la industria se hace eso para luego separar el oxígeno del nitrógeno, y a continuación cada uno de esos componentes, otra vez como gases a temperatura ambiente, se envasa en cilindros de acero. Son los cilindros de oxígeno que se usan en los hospitales, o para soldar, etc. Y el nitrógeno puro también tiene muchos usos, no tan conocidos. |
 Mezclar es fácil, pero separar...
Mezclar es fácil, pero separar...
| Muchas veces los químicos necesitan separar los componentes de una mezcla, y para eso usan una técnica denominada cromatografía. Vamos a aplicar esa técnica en un experimento sencillo que nos mostrará como se separan los componentes de la tinta de un marcador de fibra. |
|
Necesitaremos una tira de papel poroso de unos 2-3 cm. de ancho, que puede ser el papel de filtro que se usa en los laboratorios químicos o, simplemente, el borde no impreso de una hoja de diario. La longitud debe ser más o menos igual a la altura de un frasco alargado de café, mermelada, etc. A unos 3 cm. de un extremo hacemos un punto de 2-3 mm. de diámetro con un marcador de fibra de color negro y luego sujetamos con cinta adhesiva el otro extremo a la parte interna de la tapa del frasco, de manera que el extremo inferior casi toque el fondo. Vertemos alcohol fino en el frasco hasta una altura de 1 cm y luego introducimos la tira de papel colgando de la tapa, cerrando el frasco de manera que el extremo inferior quede sumergido en el alcohol. Dejamos todo en un lugar tranquilo. Veremos que el líquido subirá lentamente por la tira de papel arrastrando consigo a los colorantes que están mezclados en la tinta. Cuando el alcohol llegue al extremo superior, sacamos la tira y la dejamos secar. Con un poco de suerte, veremos que aparecerán dos o más manchas de distinto color, correspondientes a los distintos colorantes que se han mezclado para fabricar la tinta. Probemos luego con tintas de otros colores. |
 |
|
Vivimos sumergidos en un gas y respiramos un gas, que es el aire. Pero, ¿qué es un gas? Cualquier gas, como el aire, el anhidrido carbónico de las bebidas gaseosas, el cloro que se usa para fabricar agua lavandina, etc. está formado por muchísimas partículas a las que llamamos moléculas, tan pequeñas que no pueden verse con los microscopios comunes, por más poderosos que estos sean. Y efectivamente son muchísimas. Por ejemplo, en una botella de 1 litro caben más de 1022 moléculas de aire (1022 es una manera cortita de significar un 1 seguido de 22 ceros. Prueben de escribirlo...¡Es realmente una cantidad muy, muy grande!). Todos sabemos que para poder usar una bicicleta hay que inflar bien las gomas. Con el inflador forzamos la entrada de aire a la cámara: cuánto más aire entra, más moléculas habrá y mayor será la presión, lo que significa que mayor será la fuerza que el aire ejerce sobre las paredes de la cámara. Y esa fuerza se produce porque las moléculas de aire se mueven rápidamente chocando constantemente contra las paredes de la cámara: cuanto más moléculas haya, mayor será el número de choques por segundo y mayor será la presión. En una rueda de bicicleta la cubierta, más rígida, no permite que la cámara aumente de volumen. Pero si no estuviera la cubierta, esa cámara se inflaría como un globo como consecuencia del aumento de la presión. Podemos tener una idea del comportamiento de un gas por medio de una
simulación desarrollada en la Universidad de Colorado, USA, en
la cual se representa un recipiente con el cual se pueden hacer varios
experimentos y pruebas, como las siguientes: Para hacer esas pruebas debemos tener instalada la Plataforma Java en
nuestra computadora y bajar aquí la simulación,
que proviene del sitio phet.colorado.edu. Se trata realmente de un programa
muy instructivo y fácil de usar. |
| Todo el Universo, todo lo que nos rodea, nosotros mismos, estamos formados por átomos de distintos tipos. Cada tipo de átomo es lo que se denomina elemento químico. Y cada elemento químico tiene un nombre, tiene un símbolo formado por letras y tiene sus propiedades particulares. Algunos son gases, como el oxígeno (O), el nitrógeno (N) o el cloro (Cl). Unos pocos son líquidos, como el mercurio (Hg) o el bromo (Br). Y la mayoría son sólidos, como el hierro (Fe), el azufre (S), el sodio (Na) o el oro (Au). Algunos elementos son muy comunes, como el silicio (Si) y el oxígeno, que combinados forman la arena. Otros elementos, en cambio, son bastante raros o escasos, como el praseodimio (Pr), el francio (Fr) o el yterbio (Yb). |
|
Cuántos elementos químicos existen en la Naturaleza? Existen 92 en total, aunque un par de ellos no se encuentran en nuestro planeta Tierra (no nos referiremos a los elementos artificiales, creados por el hombre). El elemento más simple y liviano es el hidrógeno (H) mientras que el más pesado es el uranio (U). Estudiar como se comportan los distintos elementos, como se combina cada uno de ellos con los demás sería muy complicado si no hubiese un orden determinado. Afortunadamente, los elementos se pueden ordenar de menor o más liviano (H) a mayor o más pesado (U) en la llamada Tabla Periódica de los Elementos. En esa Tabla los elementos quedan ordenados en sentido vertical por familias de elementos con propiedades químicas parecidas, lo cual facilita enormemente su estudio. |
 |
| En la Internet podemos encontrar la Tabla Periódica ilustrada y con detalles de las propiedades de cada elemento en los siguientes sitios: Tabla1, en español; Tabla2, en inglés; Tabla3, también en inglés pero con la posibilidad adicional de bajar e imprimir la Tabla. |
| El agua es representada por los químicos
con la fórmula H2O, que significa que tiene dos átomos
de hidrógeno por cada átomo de oxígeno. Pero existe
una molécula que es pariente cercano de esta y que tiene dos átomos
de hidrógeno y dos átomos de oxígeno y que los
químicos escriben H2O2. Esa sustancia es el
"agua oxigenada" (también llamada peróxido de hidrógeno)
que se compra en la farmacia para desinfectar heridas, decolorar el pelo,
etc. debido a que libera muy fácilmente el oxígeno "extra"
y entonces resulta un oxidante muy fuerte. Para que no sea demasiado fuerte,
se la vende diluida con agua común como agua oxigenada de 10 volúmenes,
de 20 volúmenes, etc. Eso significa que un volumen de agua oxigenada
puede descomponerse liberando 10 veces, 20 veces, etc. ese volumen de oxígeno
gaseoso.
Esa descomposición para formar oxígeno gaseoso puede provocarse mezclando el agua oxigenada con un catalizador adecuado, como veremos en este par de experimentos: 1.- Necesitaremos agua oxigenada de cualquier concentración, un
frasco de vidrio limpio (de café, mermelada, etc.) y una pila de
carbón o alcalina que ya no sirva. 2.- En este segundo experimento, además del agua oxigenada y el frasco, necesitaremos uno o dos mililitros de sangre, que podemos pedir al carnicero del barrio. Luego de verter un poco de agua oxigenada en el frasco, agregamos la sangre. Otra vez, veremos un abundante desprendimiento de oxígeno por descomposición del agua oxigenada, ahora debido a una sustancia que todos tenemos en la sangre y que se llama peroxidasa. Esa sustancia, entre otras, nos protege de las pequeñas cantidades de agua oxigenada que se forman en el organismo a partir del oxígeno del aire que respiramos, y que de otra forma atacarían los tejidos acelerando el proceso de envejecimiento. En cualquiera de los dos experimentos es posible comprobar que el gas que se desprende es oxígeno introduciendo en el frasco una astilla de madera con un extremo encendido: si la cantidad de oxígeno es suficiente, veremos que comienza a arder más vivamente. |
| Si tenemos en casa algún objeto
de plata (cuchara, moneda, anillo, etc.) sabemos que lentamente el metal
se va oscureciendo. Eso ocurre porque la plata reacciona con las sustancias
presentes en el aire que contienen azufre, formándose una capa de
sulfuro de plata. Una manera de hacer que esos objetos recuperen su brillo
original es limpiarlos con algún producto que elimine o disuelva
esa capa oscura. Pero hay otra manera de hacerlo, mediante una reacción química y aprovechando que el azufre se une con más entusiasmo a otros metales que a la plata. Uno de esos metales es el aluminio. Probemos el siguiente experimento para comprobarlo: |
|
| Necesitaremos un recipiente donde
nuestro objeto de plata pueda ser cubierto con líquido. Recubrimos
el fondo del recipiente con papel de aluminio, sobre el que apoyaremos el
objeto (podemos fabricar el recipiente directamente con el papel de aluminio,
si es suficientemente grueso). Luego preparamos una solución de bicarbonato
de sodio en la cantidad de agua suficiente como para cubrir el objeto (una
cucharadita de bicarbonato por cada vaso de agua). Calentamos esa solución
hasta que hierva y, con mucho cuidado para no quemarse los dedos, la volcamos
sobre el objeto. Veremos que muy pronto la capa de sulfuro de plata comienza
a desaparecer. Si la capa es gruesa quizás sea necesario volver a
calentar la solución y volcarla nuevamente sobre el objeto. |
 |
|
Qué ocurre en este experimento? Los químicos escriben la reacción que se produce como: 3 Ag2S + Al --> 6 Ag + Al2S3 lo que significa: sulfuro de plata + aluminio -->
plata + sulfuro de aluminio En esta reacción están pasando electrones desde el aluminio
a la plata y por esa razón es necesario que el objeto de plata
esté en contacto con el papel de aluminio. Como se ve, nada de
plata se pierde, lo que si ocurre con otros métodos de limpieza. |
|
|
Material para estos experimentos: una banda de goma, de 0,5-1 cm. de ancho y 10-20 cm. de largo, comprada en una librería o cortada de una cámara en desuso de rueda de bicicleta. La goma es elástica porque está formada por largas moléculas capaces de estirarse o comprimirse como un acordeón. Cuando estiramos la banda de goma estamos obligando a las moléculas a estirarse también y a ubicarse ordenadamente una al lado de la otra. Pero en ese proceso se libera energía y la goma se calienta. Para comprobarlo, hagamos el siguiente experimento: tomamos la banda de goma de cada extremo, la estiramos rápidamente y todo lo posible teniéndola cerca de los labios o de la frente y la apoyamos rápidamente sobre la piel: notaremos que se ha calentado ligeramente. Ahora, teniendo la banda de goma bien estirada y sin soltar los extremos, la acortamos rápidamente hasta su longitud original y apoyamos la banda sobre la piel: comprobaremos que se ha enfriado, pues al volver las moléculas a su situación original, absorben energía. Y ¿qué pasará cuando calentemos o enfriemos la banda de goma? Comprobémoslo con este otro experimento: sujetamos la banda de goma por un extremo a un clavo en una pared o en una madera colocada verticalmente o de la manija de una puerta y colgamos del otro extremo un objeto que mantenga la banda estirada (un martillo, una piedra, etc.). Con un lápiz marcamos de alguna manera la posición del extremo de la banda de goma. Si ahora calentamos la banda con el aire caliente de un secador de pelo, comprobaremos que la banda de goma se acorta (¡al revés de lo que ocurre con los metales, que al calentarlos se dilatan!). ¿Cómo se explica esa observación? Imaginemos a las moléculas que forman a la banda de goma estirada como si fueran un trozo de soga o de cadena estiradas sobre una mesa. Cuando se calienta un material, sus moléculas se mueven cada vez más enérgicamente. Si sacudimos la soga o la cadena en su parte media simulando la acción del calor, sus extremos se acercarán: la “molécula” se hace más corta. ¡Eso explica porqué toda la banda de goma se hace más corta al calentarla! Para ver más claramente esta “dilatación” de la goma, se puede armar un aparatito similar al que se propone para mostrar la dilatación de los metales en el capítulo de física. Reemplazamos el tubo metálico por la banda de goma, que mantenemos estirada sujetando un extremo con un clavo y atando al otro extremo una cuerda o hilo que pase por un carrete o ruedita y quede tenso con un objeto pesado atado a su extremo. Comprobaremos que la banda de goma se estira al calentarla marcando previamente la posición de su extremo o del objeto que sirve como peso. |
|
Sabemos que la luz es producida generalmente por algún cuerpo a alta temperatura, como el Sol, la llama de una vela, el filamento de una lámpara eléctrica, etc. Sin embargo, existen reacciones químicas que producen luz a temperatura ambiente. Tenemos el ejemplo más notable en las luciérnagas, esos insectos que vemos en las noches de verano. Cómo producen esos destellos de luz? Respuesta: mediante reacciones químicas bastante complicadas, en las que la energía química de unas moléculas orgánicas se transforma en energía luminosa. En un laboratorio pueden realizarse algunos experimentos con "luminol" u otras sustancias, que producen luz a temperatura ambiente, sin calentar. Ese fenómeno se denomina quimioluminescencia. No vamos a describir esos experimentos, que requieren sustancias difíciles de conseguir, pero podemos ver algunos videos de tales experimentos en la dirección http://www.shsu.edu/~chm_tgc/chemilumdir/chemiluminescence2.html |
 Líquidos
blancos, líquidos negros...
Líquidos
blancos, líquidos negros...
|
Tenemos dos líquidos incoloros y al mezclarlos queda un líquido de color casi negro. Mezclamos otros dos líquidos incoloros y nos queda un líquido de color blanco. Ahora mezclamos el líquido blanco y el líquido negro y nos queda...otra vez incoloro. Bueno, ahora veamos como se hace esa "magia". Necesitaremos para este experimento: tintura de iodo (que se consigue en la farmacia), agua lavandina concentrada, vinagre blanco, solución de almidón (preparación explicada en el experimento sobre "Tinta invisible"), sal inglesa o sal de Epson (es sulfato de magnesio, un laxante que se compra en la farmacia), un gramo de ácido ascórbico (es la vitamina C que se consigue en una farmacia, pura o en forma de pastillas), amoníaco (si se compra en la farmacia, habrá que diluirlo con igual volumen de agua; también se puede usar el amoníaco para limpieza, siempre que sea incoloro). Y también necesitaremos un poco de paciencia para preparar las soluciones en vasos de vidrio o en frascos en desuso incoloros (de mermeladas, café, etc.)... Comencemos: Solución de lavandina: 1 cucharada de lavandina + 4 cucharadas de agua. Solución de vitamina C: disolver 1 gramo de vitamina en 6 cucharadas de agua. Y ahora las soluciones para mezclar: Solución A: 2 cucharaditas de tintura de iodo + 6 cucharadas de vinagre blanco. Agregar de a gotas solución de vitamina C hasta que desaparezca el color del iodo. Luego agregar 1 cucharadita de solución de almidón. Solución B: 1 cucharadita de solución de lavandina que preparamos antes + 6 cucharadas de agua. Solución C: Disolver 1/2 cucharadita de sal inglesa en 5 cucharadas de agua y agregar el resto de la solución de vitamina C. Solución D: 7 cucharadas de amoníaco. Una vez que tenemos todo preparado, viene la demostración: Mezclar la solución A con la solución B, agitando bien => aparece el color negro. Mezclar la solución C con la solución D, siempre agitando => color blanco. Mezclar la solución de color negro con la de color blanco => solución incolora, como eran al principio! Explicaciones para los que quieren saberlo todo: al preparar la solución A , el ácido ascórbico reduce al iodo a ioduro y el color desaparece. Al mezclar A + B, el agua lavandina (que es una solución de hipoclorito de sodio, un poderoso oxidante), vuelve a oxidar el ioduro a yodo y este reacciona con el almidón para dar un color azul oscuro, casi negro. Al mezclar C + D el amoníaco, fuertemente alcalino, hace que se forme hidróxido de magnesio, que es blanco. Al mezclar las soluciones negra y blanca, el vinagre (ácido acético) que estaba en la solución A disuelve al hidróxido de magnesio, que desaparece, y el ácido ascórbico que habíamos puesto en la solución C vuelve a reducir al yodo, que también desaparece juntamente con el color negro. |
| Para este experimento usamos unos mililitros (dos o tres cucharadas) de una solución de sulfato de cobre, como la utilizada en el experimento "De metales y pilas". Teniendo esa solución color azul celeste en un vaso o frasco de vidrio incoloro, le agregamos de a poco y agitando una solución de amoníaco: veremos que al principio se enturbia el líquido porque se forma hidróxido de cobre, blanquecino, que no se disuelve en agua. Pero si seguimos agregando amoníaco, aparece un hermoso color azul violáceo debido a que se forma Cu(NH3)4++. |
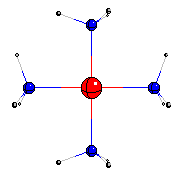 |
Ese ion tiene la forma de un cuadrado con el ion cobre con dos cargas positivas (Cu++) en el centro y una molécula de amoníaco (NH3) en cada vértice, como se ve en la figura. Si agregamos un poco de solución de ácido ascórbico (preparada disolviendo una pastilla de 1 gramo de vitamina C en 6 o 7 cucharadas de agua), el color casi desaparece. Y si calentamos ligeramente la solución y la dejamos reposar, veremos que se forma un depósito rojizo de cobre metálico como un polvo fino. Eso ocurre porque el ácido ascórbico reduce (le cede electrones, que tienen carga negativa) al Cu++ , que entonces se neutraliza y pasa a cobre metálico. |
| El anhidrido carbónico es un gas con una molécula
que posee un átomo de carbono y dos de oxígeno (CO2).
Se produce cada vez que quemamos algo (papel, leña, carbón,
nafta, gas combustible, etc.). Y también se produce cuando los alimentos
se "queman" en nuestro organismo, combinándose con el oxígeno
que respiramos. Podemos comprobarlo haciendo un experimento muy sencillo:
Primero deberemos preparar "agua de cal". Basta con poner una cucharada de cal (la que usan los albañiles) en un frasco, agregarle un vaso de agua, agitar y dejarlo algunos minutos en reposo. Luego filtrar a través de una tela fina o un filtro de papel para café. Verter un poco de "agua de cal" en un vaso o frasco de vidrio incoloro y luego hacer burbujear aire de nuestros pulmones soplando a través de un tubito o sorbete. Veremos muy pronto que el agua se vuelve turbia porque se forma carbonato de calcio, de color blanco, que está indicando la presencia de CO2. - Y si dejamos un vaso con "agua de cal" recién filtrada
en contacto con el aire, veremos que en algunas horas en la superficie
se ha formado una película blanca de carbonato de calcio, porque
ha reaccionado con el CO2 que hay en el aire. Ese mismo CO2 que
absorben las plantas para crecer. |
|
- El CO2 es el gas que tienen todas las bebidas gaseosas, desde la soda (agua carbonatada) hasta los vinos espumantes. Podemos comprobarlo fácilmente con un sifón de soda: conectamos al sifón una manguera flexible (como las que se usan en los motores de automóvil), invertimos el sifón para que salga gas pero no líquido y hacemos burbujear el gas en "agua de cal". La turbidez que se produce nos está confirmando que el gas es realmente CO2, como se observa en la figura. |
 |
|
- También podemos comprobar fácilmente que el CO2 no mantiene la combustión. Si es un recipiente algo ancho (una olla, por ejemplo) colocamos en el fondo una pequeña vela, la encendemos y luego introducimos lentamente CO2 al nivel del fondo del recipiente usando el método del sifón que vimos antes, veremos que finalmente la vela se apaga. Como el CO2 es más pesado que el aire, va llenando el recipiente (aunque no lo veamos ...) hasta que llega al nivel de la llama y esta se apaga. Es por eso que muchos extinguidores de incendios están cargados con ese gas. Comprobamos que al reaccionar el CO2 con el "agua de cal" se forma carbonato de calcio (CaCO3) de color blanco. Esa sustancia aparece en la naturaleza en forma de distintos minerales, como la piedra caliza o el mármol, y es muy soluble en ácidos. Entonces, si luego de los experimentos que hemos descrito agregamos vinagre al frasco en el que se ha formado carbonato de calcio veremos que el sólido se disuelve y el líquido queda nuevamente incoloro, porque el vinagre contiene ácido acético. |
| Ya se había mencionado en el punto anterior que el carbonato de calcio se disuelve en el ácido acético. Y al disolverse se forma un gas, el CO2. El bicarbonato de sodio (NaHCO3), que se usa para cocinar y para combatir la acidez de estómago, también reacciona de forma similar con los ácidos. Hagamos el siguiente experimento para demostrarlo: En un vaso ponemos una cucharada de bicarbonato de sodio, le agregamos unas gotas de detergente concentrado y después un cuarto de vaso de vinagre (puede ser "vinagre blanco" o "vinagre de alcohol", que es como se denomina en Argentina al ácido acético diluído). Veremos como se produce una reacción rápida con formación de CO2 gaseoso y se forma una espuma que pronto desborda el vaso. Para que el experimento sea un poco más espectacular se puede agregar unas gotas de colorante para comidas o de azul de metileno juntamente con el detergente. Aquí agregamos un video de la reacción. |
| El metal con que se fabrican las monedas debe
ser muy resistente, para durar muchos años. Pero queremos decir resistente
químicamente, para que no sea atacado fácilmente por los ácidos
de las manos, por ejemplo. Para darle esa resistencia, generalmente se usa
cobre en aleaciones con otros metales, lo que puede comprobarse mediante
un sencillo experimento: Colocamos un trozo de papel poroso (una servilleta doblada en cuatro, por ejemplo) en un plato y lo empapamos con vinagre. Sobre el papel húmedo apoyamos dos o tres monedas y dejamos todo en un lugar tranquilo, cuidando que el papel no se seque. Veremos que poco a poco las monedas y el papel que las rodea van tomando color verdoso. Ese color aparece porque el ácido acético del vinagre, juntamente con el oxígeno del aire, van atacando el metal. Los iones cobre liberados del metal reaccionan entonces con el anhídrido carbónico del aire formando carbonato de cobre, de color verde. Ese color también suele verse en viejos techos protegidos con chapas de cobre, que son lentamente atacadas por los componentes de la atmósfera. |
| Muchas tintas negras o azul-negras son preparadas
con un pigmento ferrogálico, que es el que proporciona el color.
Ese pigmento se forma al reaccionar una sal férrica [los químicos
dicen también una sal de hierro(III), porque el estado de oxidación
del hierro es 3] con ácido gálico. Ese ácido es un
compuesto orgánico que se encuentra en muchos vegetales, como las
hojas de te y de yerba mate. Para ver como se forma ese pigmento negro hagamos
el siguiente experimento: Necesitaremos una sal férrica, como el sulfato férrico. Más fácil de conseguir es el sulfato ferroso, que es una sustancia que se le pone a algunas plantas de jardín y que se puede comprar por poco dinero en una ferretería o un negocio de venta de plantas. Disolvemos media cucharadita de sulfato ferroso, de color verde claro, en medio vaso de agua y le agregamos unas gotas de agua oxigenada: veremos que la solución toma un color marrón-rosado porque el hierro(II) pasa a hierro(III). Si ahora mezclamos esa solución con una infusión de te común o de yerba mate, veremos que se forma una sustancia negra, que es el pigmento que le da el color a muchas tintas. ¡Y que por supuesto se conoce desde hace siglos! Y también podemos usar la solución de hierro como tinta invisible: si escribimos en un papel con esa solución y dejamos secar, lo que está escrito no se verá. Pero vuelve a aparecer si mojamos el papel con te o con mate cocido. ¡Buenísimo! |
| Los fuegos artificiales nos maravillan por la
diversidad de colores que muestran. Esos colores resultan del agregado de
distintas sales metálicas a la pólvora usada en su fabricación.
Con un poco de cuidado pueden producirse algunos de esos colores en la cocina
de casa (¡pidiendo antes permiso!...). Para hacer este experimento
en primer lugar habrá que conseguir unos 10 o 15 cm de alambre fino
y, con una pinza, hacerle un pequeño ojal en un extremo. Eso nos
servirá como soporte para las sustancias que vayamos a calentar.
Luego encendemos una hornalla de la cocina y probamos lo siguiente: - Compuestos de litio (el símbolo es Li): con el alambrecito tomamos una pequeña cantidad de grasa de litio y la calentamos en la llama; veremos que inicialmente aparece fugazmente el color rojo, luego se quema la grasa con llama amarilla (debido a las partículas de carbón que se forman), y finalmente suele aparecer nuevamente el color rojo. - Compuestos de sodio (el símbolo es Na): tomamos un poco de sal común, que es cloruro de sodio (NaCl), con el alambrecito mojado y lo calentamos en la llama. Veremos el color amarillo intenso característico del sodio. También podemos hacer caer algunos granitos de sal sobre la llama, con el mismo resultado. - Compuestos de cobre (el símbolo es Cu): con el alambrecito húmedo tomamos una pequeña cantidad de sulfato de cobre (CuSO4.5 H2O) y lo llevamos a la llama. Veremos que aparece el color verde durante algunos segundos. - Compuestos de calcio (el símbolo es Ca): con el alambre tomamos una pequeña cantidad de yeso (sulfato de calcio, CaSO4) y lo calentamos fuertemente en la llama. Se verá un color rojo ladrillo, aunque en forma muy tenue. |
|
La propuesta es preparar un líquido que cambia de color cuando
se agita con fuerza. Para eso hacemos lo siguiente: en un vaso lleno
de agua filtrada o agua mineral (que no tenga cloro) disolvemos tres
cucharaditas de miel y media cucharadita de soda cáustica (que
se compra en la ferretería). Si no conseguimos soda cáustica
usamos dos cucharaditas de limpiador de hornos. Necesitaremos también
una solución de azul de metileno (0,2 g en 100 ml de agua pura),
de la cual agregamos 2 o 3 gotas a la solución anterior. |
La Página de la Ciencia. 3/17