

 |
 |
 |
|
||
|
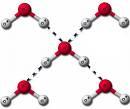
El agua, líquido mágico... El agua está formada por pequeñas
partículas que llamamos moléculas. La molécula del
agua es H2O, o sea que está formada por 1 átomo
de oxígeno (símbolo O) y 2 átomos de hidrógeno
(símbolo H) y es una molécula muy livianita, mucho
más liviana que las moléculas de los gases que forman la
atmósfera (oxígeno, O2 y nitrógeno, N2) ¿Porqué
entonces el agua no es un gas? No es un gas porque los átomos de
hidrógeno tienen la extraordinaria propiedad de formar puentes
con los átomos de oxígeno que estén cerca, como muestra
la Figura 1. Cada molécula de agua está entonces "enganchada"
a las otras moléculas vecinas y no puede escapar fácilmente.
Y por eso el agua es un líquido. |
 |
 |
 |
| Figura 1 | Figura 2 | Figura 3 |
Para demostrar algunas propiedades del agua, podemos hacer estos experimentos:
|
Experimento 1: ¿Cuándo moja el agua? ¡No hay dudas de que el agua moja, sobre todo cuando una lluvia
nos sorprende sin paraguas! Pero para que el agua moje, debe caer sobre
una superficie formada por moléculas que se hagan "amigas"
de las moléculas de agua y que acepten los puentes que forman los
átomos de hidrógeno, como decíamos antes. Hagamos
el siguiente experimento: |
|
Experimento 2: El agua y el aceite no quieren mezclarse si no hay detergente. Como vimos en el experimento anterior, el agua y el aceite no se hacen
"amigos". ¿Qué pasa entonces si echamos aceite
en agua? Bueno, es cuestión de probar mediante este experimento: Pero ¿qué es un detergente? Es una sustancia que tiene
moléculas formadas por una "cabeza" que se hace "amiga"
del agua y una "cola" muy larga que se hace "amiga"
de las grasas y aceites, funcionando como "puente" entre ambas.
Y el jabón tiene moléculas muy parecidas, como se ve en
la Figura. |
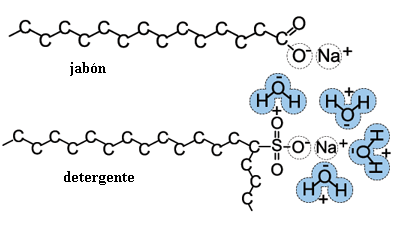 |
| Lo que vemos en la figura son fórmulas químicas de las moléculas de jabón y de detergente. La cola de esas moléculas está formada por muchos átomos de carbón (símbolo C) unidos entre sí. Y en la "cabeza", donde se acercan las moléculas de agua representadas con color azul, aparecen átomos de oxígeno (símbolo O). |
| Experimento 3: Demostrando la existencia
de la tensión superficial.
Habíamos visto como, gracias a la tensión superficial, algunos insectos pueden caminar sobre la superficie del agua. Pero esa propiedad permite que también floten cuerpos que son mucho más densos que el agua, como se demuestra en el siguiente experimento: Llenemos un vaso con agua y depositemos con cuidado sobre la superficie
del líquido una aguja de coser mantenida por un trocito de papel
de diario u otro papel poroso, como se ve en la Figura. Veremos que después
de algunos segundos el papel se empapa con agua y se va al fondo del vaso,
dejando a la aguja flotando gracias a la tensión superficial. Se
nota que la superficie se hunde un poco alrededor de la aguja. Es un resultado
bastante sorprendente, si se tiene en cuenta que el acero es mucho más
denso que el agua (7,8 g/cm3). |
 |
|
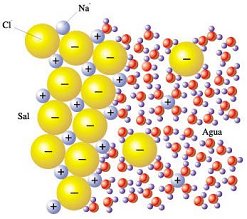
Experimento 4: ¿Qué cosas se disuelven en agua? Hagamos el siguiente experimento: preparamos cuatro vasos o frascos
de vidrio llenos con agua hasta la mitad. La sal. La sal común es cloruro de sodio, según
los químicos. ¿Alguna vez observaron de cerca, por ejemplo
con ayuda de una lupa, los granitos de sal común? Verán
que muchos de esos granitos son cubos mas o menos perfectos. Esa forma
externa tan regular revela que los átomos o las moléculas
que forman esos cristales están sumamente ordenados. En la sal
común, por ejemplo, existen átomos cargados eléctricamente
(iones) ordenados como muestra la figura 1, donde los iones amarillos
son cloruros (Cl-) y los azules son sodios (Na+). Esos iones se muestran
separados entre sí para que pueda verse claramente el ordenamiento,
pero en realidad están en contacto. |
 |
|
| Figura 1 | Figura 2 |
| Cuando echamos sal en el agua, las moléculas de agua rodean a los iones positivos y negativos y los separan, como se ve en la Figura 2. Como consecuencia, el cristal de sal se deshace y se disuelve. |
| El azúcar. En los cristalitos de azúcar, que también parecen cubitos, no hay iones cargados eléctricamente. Hay moléculas sin carga como la que se ve en la Figura: |
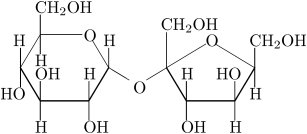 |
| Esa es la fórmula química de la sacarosa, que es el azúcar común. Está formado por dos anillos de átomos de carbono (símbolo C, aunque se omiten en los anillos para no complicar la figura) y oxígeno, unidos por un oxígeno (símbolo O). Pero lo más interesante es que la molécula tiene un montón de grupos OH, que es justamente lo que tiene la molécula de agua (H2O, que también podemos escribir HOH). Entonces se entiende que las moléculas de agua y de azúcar se hagan "amigas", que el agua rodee a cada molécula de azúcar y que los cristalitos se deshagan y se disuelvan. |
| La arena. La arena común está formada en gran parte por granitos de cuarzo, que es dióxido de silicio, SiO2. La estructura química es algo así: |
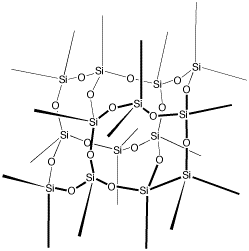 |
| En la figura se ve que los átomos de silicio (símbolo Si) y de oxígeno (símbolo O) están unidos entre sí formando una red infinita en tres dimensiones que es extraordinariamente estable. Aquí no hay iones cargados ni moléculas relativamente chicas con grupos OH y el resultado es que las moléculas de agua ya no pueden interponerse entre los átomos y la arena no puede disolverse en el agua. Y lo mismo ocurre con muchos minerales. |
| La parafina. La cera de parafina que se usa para fabricar velas es un hidrocarburo, o sea que tiene moléculas formadas solamente por carbono (símbolo C) e hidrógeno (símbolo H), como se ve en la Figura: |
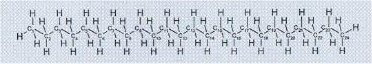 |
| A diferencia del azúcar, la parafina no tiene grupos OH y en consecuencia no se disuelve en el agua. Y lo mismo ocurre con las grasas, por ejemplo. |
| Experimento 5. El agua con sal disuelta conduce
la corriente eléctrica.
Hagamos el siguiente experimento: |
 |
|
Si ahora llenamos el recipiente con agua destilada (que se compra en
la farmacia) veremos que el LED no enciende o enciende débilmente. El agua destilada es agua pura y está formada solo por moléculas H2O. En cambio, el agua de la canilla, el agua mineral, el agua de los ríos y lagos, etc. siempre tienen algunas sales en disolución y en consecuencia conducen la electricidad. |
| Experimento 6. La corriente eléctrica
puede descomponer el agua.
Vamos a repetir el experimento anterior con la solución de sal pero sin interponer un LED, lo que permite que la corriente circule con más intensidad. Entonces veremos que en cada uno de los clavos aparecen burbujitas de gas. Lo que está ocurriendo es que, por pasaje de la corriente eléctrica, se está descomponiendo el agua de la solución en sus dos componentes: oxígeno, que se desprende sobre el electrodo positivo (se ve claramente) e hidrógeno, que se desprende sobre el electrodo negativo (menos evidente). Ese proceso se denomina electrólisis del agua. ¿Pero porqué se forman esos gases por efecto de la electricidad? Ya sabemos que el agua tiene dos átomos de hidrógeno por cada átomo de oxígeno en forma de moléculas H2O. Aún en el agua pura, unas pocas de esas moléculas se descomponen en los iones H+ y OH-, que son los que se neutralizan en los electrodos de nuestro experimento y forman el hidrógeno y oxígeno gaseosos. |
| Experimento 7. Los tres estados del agua.
A temperatura ambiente el agua es un líquido, como todos sabemos. Pero el agua se evapora bastante fácilmente, como comprobamos cuando ponemos a secar la ropa recién lavada. Entonces el agua pasa al estado de vapor, las moléculas H2O se separan entre sí y se mezclan con el aire. Ahora consideremos el agua en su estado sólido, que es
el hielo. Llenemos un vaso hasta la mitad con agua y agreguemos un cubito,
sacado del congelador de la heladera. Y veremos lo siguiente: 1.- El cubito de hielo flota en el agua líquida ¿porqué? porque el hielo es menos denso (o más liviano) que el agua. En el Experimento 2 vimos que la densidad del agua es de 1,0 g/cm3. En cambio el hielo es más liviano, con una densidad de 0,92 g/cm3, y entonces flota, aunque la mayor parte del cubito queda debajo del agua. Como los témpanos en la Antártida. Cuando veamos una foto de esas moles que flotan en el mar, imaginémonos todo lo que queda fuera de la vista, debajo del agua... |
 |
| 2.- Se observa que cuando el agua del
vaso se enfría comienzan a condensar gotitas de agua del lado de
afuera del vaso. Esa agua estaba como vapor mezclada con el aire pero al
enfriarse pasa de nuevo al estado líquido. Ocurre lo mismo que cuando
hierve agua en una pava y ponemos una cuchara delante del pico: el vapor
condensa como agua líquida.
De esa manera, hemos visto los tres estados del agua: vapor (o gas), líquido y sólido (hielo). |
| Experimento 8. Cuando el agua se enfría
aumenta de volumen, al revés que la mayoría de las sustancias.
Para comprobarlo hagamos el siguiente experimento: Consigamos una pequeña botella o frasco de vidrio con tapa metálica,
como las que se usan para píldoras medicinales. La llenamos completamente
con agua y la cerramos con su tapa, fuertemente apretada. Ahora colocamos
el frasco dentro de una lata vacía (de tomates o duraznos al natural)
y llevamos todo al congelador ("freezer") de la heladera. Al
otro día comprobaremos que la tapa ha sido forzada hacia afuera
por el agua congelada, que ahora desborda del frasco al haber aumentado
de volumen. También puede ocurrir que, si no cede la tapa, se rompa
el frasco de vidrio por la enorme presión que ejerce el agua al
aumentar de volumen; por eso es conveniente poner el frasco dentro de
una lata, que retendrá los pedazos de vidrio que puedan desprenderse. Pero ¿porqué aumenta de volumen el agua al congelarse? Ya mencionamos que el agua es líquida a temperatura ambiente porque se forman puentes de hidrógeno entre las moléculas, que se mueven constantemente. Pero cuando enfriamos el agua los movimientos de las moléculas se hacen más lentos y los puentes de hidrógeno se hacen más ordenados, hasta que se forma hielo con esta estructura: |
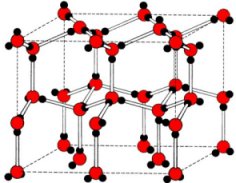 |
| Es una estructura bastante abierta, donde las moléculas de agua están más alejadas entre sí que en el líquido y ocupan más lugar. Entonces, el hielo es menos denso que el agua líquida. |
| Experimento 9. El fenómeno
de la capilaridad.
La capilaridad es un fenómeno por el cual el agua asciende en
un tubo muy fino o entre dos vidrios planos separados por una distancia
muy pequeña, por ejemplo. Esto ocurre cuando el agua se adhiere
con más fuerza al vidrio que la fuerza con que las moléculas
de agua se atraen entre sí. Hagamos ahora un par de experimentos para ilustrar el fenómeno de la capilaridad: Exp. 1: Llenamos un vaso con agua coloreada hasta una altura de
2 o 3 centímetros. El colorante puede ser azul de metileno, colorante
rojo para canarios, colorantes para alimentos, etc. También sirve
un poco de vino tinto... Exp. 2: Necesitaremos dos portaobjetos para microscopía, que son láminas delgadas de vidrio (preguntar a algún bioquímico o en una farmacia). Pegar una cinta adhesiva a lo largo de cada borde de un portaobjetos, cubriendo 3 o 4 milimetros de vidrio. Repetir el procedimiento dos o tres veces para engrosar la cinta. Superponer el segundo portaobjeto, de manera que los dos vidrios queden separados por un pequeño espesor, y mantenerlos juntos con un par de trozos de cinta. Si ahora sumergimos un extremo de ese "sandwich" en agua coloreada, veremos que el líquido sube lentamente por capilaridad hasta alcanzar una altura que dependerá de la distancia que separe los dos vidrios. |
|
 |
 |
|
Y así terminamos con esta serie de experimentos sencillos, con los cuales hemos demostrado algunas de las propiedades más importantes del agua, ese líquido del cual depende el clima de nuestro planeta Tierra y del cual dependemos todos los seres vivientes. |
|
![]() Arriba
Arriba ![]() Volver
al capítulo de Química
Volver
al capítulo de Química
La Página de la Ciencia. 11/14